Kemi A/Atomernas byggnad
| Föregående: Introduktion | Upp: Kemi A | Nästa: Grundämnenas släktskap |
| Formelsamling | Övningar | Facit |
Det här avsnittet beskriver atomernas byggnad.
Idén att all materia är uppbyggd av en minsta delbar enhet härstammar från antiken. Demokritos antog, utifrån rent filosofiska grunder, att ingenting kan delas upp i allt mindre delar i all oändlighet. Han kallade de partiklar som alltså var odelbara för atomer (grekiska: atomos, "odelbar"). Det tog sedan nästan 2 000 år innan John Dalton utförde experiment som visade att all materia verkligen är uppbyggd av små odelbara enheter. Sedan dess har t.ex. atombomber visat att atomerna visserligen utgör mycket starka byggstenar men att de inte är odelbara. Som vi ska se i detta avsnitt består atomer i själva verket av mindre delar. Dessa delar inte bara förklarar varför atomerna är alltings byggstenar, delarna utgör också de komponenter som vi behöver för att förstå varför olika ämnen beter sig som de gör.
Mänskligheten har visserligen lärt sig att spränga atomer, vilket frigör fantastiska mängder energi, men inom kemin studerar man bara vad som händer när olika atomer reagerar med varandra. Atomernas inre lämnas med andra ord gärna åt sig själv (eller fysikerna) men atomernas inre är av största betydelse för hur de reagerar med varandra. Här ska vi alltså titta närmare på hur atomerna är uppbyggda. I själva verket har atomernas inre byggstenar visat sig mycket svåra att förstå sig på och en förståelse för deras egentliga natur hänger ihop med förklaringen till hela universums uppkomst. I detta avsnitt ska vi emellertid begränsa oss till en förenklad modell av atomen.
| Faktaruta | |
|---|---|
| Lite om universum och hur atomerna skapades... | 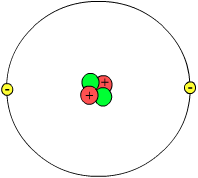
|
| Här saknas information! Hjälp Wikibooks genom att fylla i mer. | |
Atommodell
redigeraFör att förstå varför vissa ämnen reagerar lättare med varandra än andra måste man förstå hur atomerna är uppbyggda. Vår kunskap om atomernas inre bygger på de upptäckter som gjordes av vetenskapsmän före och efter sekelskiftet 1900. Den förenklade atommodell de kom fram till att är den som vi ska presentera här.
| Bilder | |
|---|---|
| Atomkärna (med protoner och neutroner). | Atom med elektronmoln |
| Atommodell av väte | Atommodell av t.ex. natrium |
Till skillnad från vad man länge trodde är inte atomerna odelbara. Istället består de av mindre partiklar som kallas elementarpartiklar: Protoner, neutroner och elektroner. En atom består av en positivt laddad atomkärna som innehåller protoner och neutroner tillsammans kallade nukleoner. Denna kärna omges av negativt laddade elektroner och deras negativa laddning uppvägs av den positiva laddningen hos protonerna i atomkärnan. Man säger att elementarladdningen eller enhetsladdningen hos protonerna och elektroner är +1 respektive -1. Neutronerna saknar laddning.
Protoner och neutroner väger båda ungefär kg medan elektronernas massa är mindre. Eftersom det inte är så praktiskt att mäta elementarpartiklarnas vikt på detta sätt har man hittat på en speciell massenhet för dem kallad u (Unified Mass unit).
| Elementarpartikel* | Symbol | Massa/kg | Massa/u | Laddning |
|---|---|---|---|---|
| Elektron | 0.000549 | -1 | ||
| Proton | 1.0073 | +1 | ||
| Neutron | n | 1.0087 | 0 | |
| *Notera att det även finns andra elementarpartiklar, men dessa tas inte upp här. | ||||
Atomnummer
redigeraEtt grundämne är ett ämne, ibland kallat ett element, som består av atomer med samma antal protoner i atomkärnan. Detta antal är grundämnets atomnummer. I det periodiska systemet är grundämnena sorterade efter stigande atomnummer.
(Se Formelsamling/Kemi/Periodiska_systemet).
Masstal
redigeraOm man för en viss atom räknar ihop antalet protoner och neutroner får man atomens masstal. Eftersom elektronernas massa är försumbar jämfört med neuklonernas kan man bortse från denna och, eftersom neuklonernas massa är ungefär lika med 1 u, ligger masstalet mycket nära atomens vikt.
Isotoper
redigera| Isotoper av grundämnet väte | ||||
|---|---|---|---|---|
| Isotopens namn | Atomnummer | Masstal | Symbol | Massa |
| Väte | 1 | 1 | H | 1 u |
| Deuterium | 1 | 2 | H | 2 u |
| Tritium* | 1 | 3 | H | 3 u |
| Tetranium/Quadium* | 1 | 4 | H | 4 u |
| *dessa ämnen är syntetiska, dvs de har skapats av människan. | ||||
Hos de flesta grundämnena varierar antalet neutroner i kärnan. Atomer med samma antal protoner men olika antal neutroner kallas för isotoper. Två isotoper har i praktiken identiska kemiska egenskaper men deras fysiskaliska egenskaper, smältpunkt, kokpunkt etc, kan variera mer. Några isotoper har egna namn, de övriga namnges efter ämnets beteckning och masstal, t.ex. klor-35, klor-37 där siffran anger antalet protoner + antalet neutroner.
Elektronkonfiguration
redigera| Bildserie på en atom med en elektrons rörelse- och lägesenergi som vektorer vid tillförsel av energi. |
| Elektronen "hoppar" mellan elektronskalen när man tillför energi. |
När stabila grundämnen bildas, då protoner och elektroner förenas, avges energi. Detta beror på att dessa atomer innehåller mindre energi än de fria elementarpartiklarnas sammanlagda energi. De elektriska laddningarna hos en atoms protoner och elektroner väger upp varandra så länge antalet protoner och elektroner är lika många. Denna balans kan man dock rucka på genom att tillföra atomen energi. Om man vill skilja protonerna och elektronerna åt igen, s.k. jonisering, måste man alltså tillföra lika mycket energi som frigjordes då atomen bildades. En stabil atom förblir alltså stabil endast så länge dess energimängd understiger ett visst bestämt värde.
När man tillför en atom energi är det dess elektroner som upptar överskottsenergin. Den energi som finns i en elektron är summan av dess rörelseenergi och den lägesenergi den får av atomkärnans attraktionskraft. Rörelseenergin gör alltså att elektronerna far runt atomkärnan i banor. Dessa banor kan inte beskrivas exakt och elektronernas position kan därför inte heller bestämmas. Man brukar därför säga att en atomkärna är omgiven av ett elektronmoln eller ett elektronhölje. Men även om inte elektronernas position kan bestämmas exakt kan man räkna på hur sannolikt det är att en elektron påträffas inom ett visst område. När man gör det ser man att elektronerna tenderar till att befinna sig oftare på vissa bestämda avstånd från atomkärnan. Detta beror på att atomer bara kan ta emot energi i vissa bestämda mängder, s.k. energikvanta. Man kallar dessa bestämda avstånd för atomens elektronskal och betecknar dem K, L, M, N etc.
Den energi man tillför till en atom upptas alltså av elektronerna i form av rörelseenergi vilket gör att avståndet mellan kärnan och elektronen ökar, elektronerna hoppar upp till nästa skal, man säger att atomen blir "exciterad". Exciterade atomer blir sällan långlivade och elektronerna hoppar snabbt tillbaka till det skal det befann sig i då atomen var stabil. När detta sker avges energi tillskottet i form av ljus. Om man tillför tillräckligt mycket energi lämnar elektronen atomen och hoppar t.ex. över till en annan atom. Resultatet blir en atom som saknar en elektron, dvs en positivt laddad jon.
| Bildserie på atommodeller från ämnena i t.ex. grupp 1. |
| Atomer med lika många valenselektroner har identiska kemiska och fysikaliska egenskaper. |
Hur många elektroner som befinner sig i de olika skalen, atomens elektronkonfiguration, avgör atomernas kemiska och fysikaliska egenskaper. I det periodiska systemet är grundämnena ordnade så att alla grundämnen i en grupp har lika många elektroner i sitt yttersta skal, s.k. valenselektroner. Ämnena i en grupp har likartade egenskaper eftersom de har lika många valenselektroner. Eftersom elektronkonfigurationen har så stor betydelse använder man flera typer av formler för att beskriva den.
Elektronformler beskriver antalet valenselektroner hos ett grundämne:
|
| |||||||||||||||||||||||||||
Man kan också beskriva elektronkonfigurationen på formen
- Ar 2-8-8
där siffrorna motsvarar antalet elektroner i varje skal.
Sammanfattning
redigera
|